消化系统肿瘤
一、食管癌
掌握——食管癌临床表现、诊断方法和治疗原则
熟悉——食管癌的致病诱因、病理
了解——食管癌早期治疗的重要性
(一)概述
• 全世界每年约30万人死于食管癌。
• 我国是食管癌的高发地区之一,每年平均病死约15万人。
• 发病年龄多在40岁以上,男多于女。
• 食管癌是发生于食管粘膜上皮的恶性肿瘤。
• 我国高发区有河北、河南(林县)、山西交界的太行山区,
• 四川省的北部地区,闽粤交界地区和新疆哈萨克族居住地区。
得了噎食症,食麦不食秋
(二)病因学
➢ 化学病因:亚硝胺类化合物
➢ 生物性病因:真菌作用
➢ 烟、酒、热食饮食(几度?>55℃)、口腔不洁等因素
➢ 食管原有疾病发生癌变
• 食管上皮过度鳞状化生
• 柱状上皮化生(Barrett食管(这个在胃反流性食管炎那边也有哦):下段食管扁平上皮→柱状上皮
• 食管瘢痕狭窄:较正常人群高1000倍,多在15-25年发生
• 贲门失弛缓症
• 食管裂孔疝及返流性食管炎
➢ 微量元素缺乏: 缺乏钼、锌、硒,氟与食管癌发生有关。
➢ 维生素类缺乏:Vit A、B2、C等
➢ 遗传易感性:60%的食管癌患者有家族史
(三)病理学
胸中段食管癌多见,下段次之,上段较少
绝大多数发生于粘膜上皮,少数为中胚叶组织来源的肉瘤
鳞状细胞癌——95%
腺癌——5%
腺棘瘤——腺癌和鳞状细胞癌合并存在
未分化小细胞癌——少见
肉瘤——平滑肌肉瘤
病理形态:髓质型(50-60%);蕈伞型(15-20%);溃疡型(10%);缩窄型(5-10%)
大体病理类型
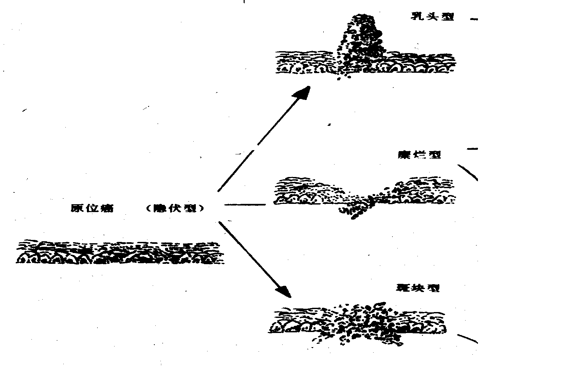
早 期
隐伏型:病变略显粗糙,色泽变深。
糜烂型:粘膜轻度糜烂或略凹陷,边缘不规则地图样,界清。
斑块型:粘膜局限性隆起,呈灰白色斑块状
乳头型:肿瘤呈外生结节状隆起,乳头状或息肉状突入管腔。
中晚期
髓质型:呈管状肥厚,上下端边缘呈坡状,恶性程度高,转移快。
缩窄型:环形生长,较早出现阻塞。
蕈伞型(他真的很重要):扁平肿块,向腔内呈蘑菇样突起。
溃疡型:瘤体粘膜面呈深陷而边缘清楚的溃疡,梗阻较轻。
腔内型:较大瘤体向腔内生长,常有蒂,外侵轻,梗阻不重,切除率高。

小结




Barrett食管炎
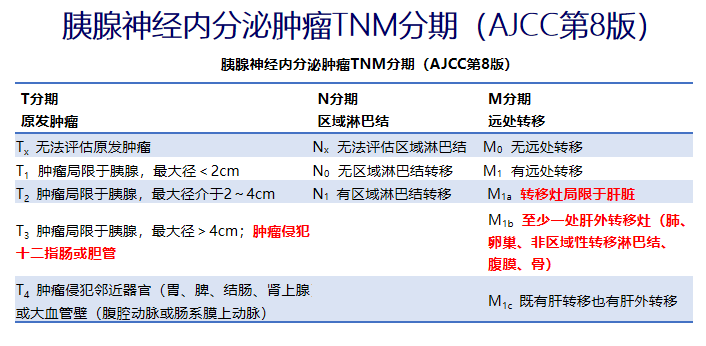
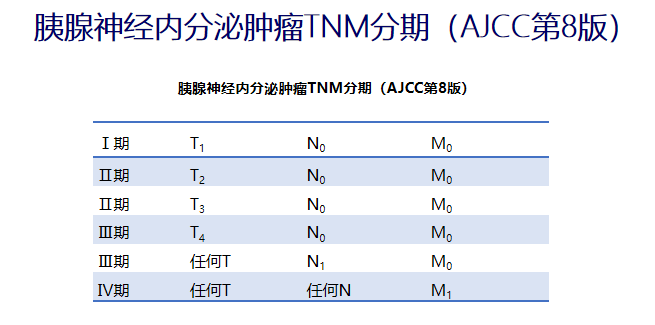
TNM分期
T——肿瘤原发灶的情况
N——淋巴结
M——远处转移
粘膜——固有肌层——浆膜层
(四)扩散及转移
直接浸润
• 在管壁内上、下两个方向扩散,沿食管固有膜或粘膜下层淋巴管侵润,远达主病灶5-6cm;向上扩散较向下扩散远
• 向外侵袭,直接侵犯相邻器官
淋巴转移
• 食管癌转移的主要途径,可发生“跳跃”转移
• 主要转移途径:食管旁淋巴结-气管旁淋巴结-锁骨上、颈部淋巴结
• 颈段:喉后、颈深和锁骨上淋巴结
• 胸段:食管旁淋巴结 (胸顶纵隔淋巴结、 气管、支气管、肺门、贲门周围的膈下、胃)
体格检查锁骨上淋巴结即可判断是否癌症转移
血行转移
• 较少,且发生晚。尸解1/3肿瘤局限于食管及其周围组织
• 肝、脾、骨、肾、大网膜、腹膜、肾上腺
(五)临床表现
早期症状:
-90%有症状,10%无症状
-咽下粗硬食物梗噎感
-胸骨后烧灼样、针刺样或牵拉摩擦样疼痛
-食物通过缓慢,并有停滞感或异物感
-梗噎停滞感通过吞咽水后缓慢消失
-症状时轻时重,进展缓慢
• 上述症状不特异,且不明显,断续发作,易被忽略
进展期症状
• 进行性吞咽困难,先是难咽干食、继而半流质、最后水和唾液也不难咽下。
• 长吐粘液样痰,为下咽的唾液和食管的分泌物。
• 梗阻较重者:呕吐。
• 逐渐消瘦、脱水、无力。
晚期症状(重点)
• 持续性胸背疼痛表示为晚期症状,肿瘤外侵。
• 邻近器官受累:
• 喉返神经——声嘶
• 颈交感神经—— Horner 综合征(眼睑下垂、瞳孔缩小、少汗、眼球内陷)
• 气管、支气管——呛咳、肺部感染
• 压迫上腔静脉——上腔静脉梗阻综合征(颈静脉怒张)
• 压迫气管——呼吸困难
• 压迫心脏——心悸
• 远处转移症状:淋巴结肿大、肝转移、脑转移、腹腔转移等
(六)诊断
病史
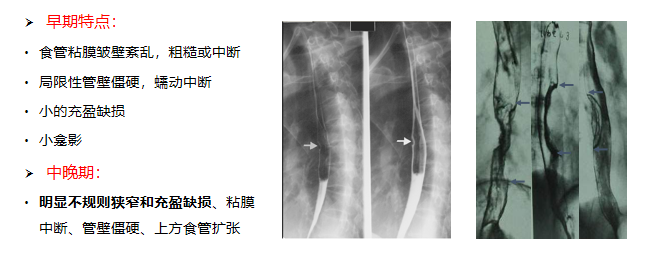
X线食管吞钡检查
内窥镜检查(纤维食管镜)
• 了解有无粘膜红肿、糜烂、隆起、凹陷、斑块及新生物
• 早期癌阳性率高80%
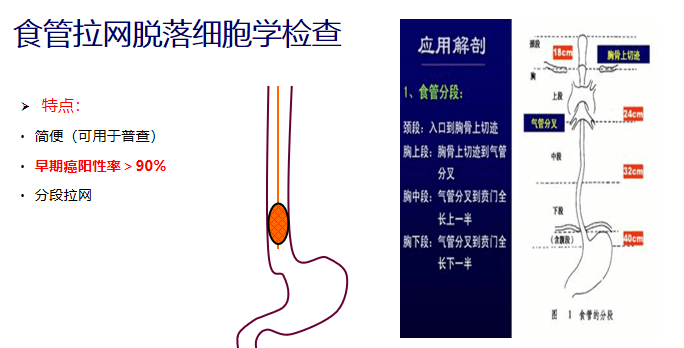
食管拉网脱落细胞学检查
CT检查
• 对较大肿瘤,显示肿瘤大小、外侵情况
• 纵隔、腹腔、肺转移情况
超声内镜检查
• 判断食管癌的浸润层次、向外扩展深度以及有无纵隔、淋巴结或腹腔脏器转移等
(七)鉴别诊断
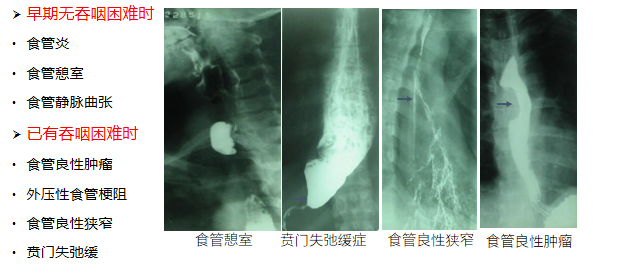
(八)治疗
手术治疗
手术是首选也是最重要的治疗方法。
长度颈段<3cm、胸上段< 4cm、胸下段< 5cm,肿瘤切除机会较大。
手术切除率58-92%。
手术后五年生存率8-30%,十年生存率5.2-24%。
手术并发症发生率6.3-20.5%。
手术死亡率5%。
辅助治疗和新辅助治疗(没那么重要)
放射治疗
• 放射和手术综合治疗,可增加手术切除率,也能提高远期生存率。
• 颈段和上胸段食管癌效果优于中下段食管癌。
术前放疗:
使癌肿及转移的淋巴结缩小,周围小的血管和小的淋巴管闭塞提高手术切除率,减少手术中播散。
放疗后2-3周手术较为适宜。
术后放疗
术中切除不彻底者,术中做标记,一般在术后3-6周开始放疗。
单纯放疗
多用于颈段、胸上段食管癌,因手术困难大、手术并发症多,疗效常不满意;
手术无法切除、有手术禁忌、患者拒绝手术者。
也可用于有手术禁忌症而病变不长,病人尚可耐受放疗者。
化学治疗
多采用与手术、放疗、中医中药等相结合的综合治疗
有时可提高疗效,或使食管癌患者症状缓解
单纯化疗疗效差,用于晚期食管癌
单纯化疗:不能耐受手术、放疗的晚期病人。
术前化疗:缩小病变,减少术中肿瘤扩散
术后化疗:以提高五年生存率
综合治疗
两种以上疗法同时或先后使用称为综合疗法
结果显示以综合治疗效果较好
小结



二、胃癌
掌握——胃癌的临床表现,诊断方法和治疗方式
熟悉——胃癌的病理类型,手术方式和原则
了解——胃癌的病因学,辅助治疗方式
(一)病因
地域因素
• 我国:西北与东部沿海地区发病率明显高于南方地区
• 全球:日本发病率最高;而美国则很低
饮食生活因素
• 食品中亚硝酸盐、真菌毒素、多环芳烃化合物含量高
• 食品中缺乏新鲜蔬菜与水果
• 吸烟
幽门螺旋杆菌(HP)感染
(请回忆一下在胃炎学过的四联疗法)
(1)促进胃黏膜上皮过渡增殖
(2)产氨,中和胃酸,亚硝氨增加
(3)代谢产物直接促进胃黏膜转化
(4)DNA转换到黏膜细胞中致癌
(克拉霉素/阿莫西林/喹诺酮(三选二)+奥美拉唑+枸橼酸铋钾)
慢性疾患和癌前病变
• 胃息肉:腺瘤性息肉、直径>2cm癌变几率大
• 慢性萎缩性胃炎:常伴有肠上皮化生或黏膜上皮异型增生
• 胃部分切除后的残胃:多发生在术后15~25年(残胃癌的概念)
遗传和基因

(二)病理
胃癌好发部位依次为胃窦、贲门、胃体、全胃;胃小弯多于胃大弯
大体类型
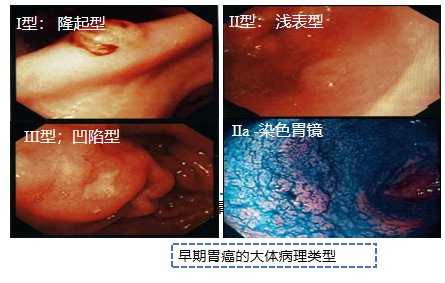
早期胃癌:
指病变仅限于黏膜或黏膜下层,不论病灶大小或有无淋巴结转移
一点癌

进展期胃癌

皮革胃——胃壁坚硬如皮革,是进展期最后的胃癌
腺癌(肠型和弥漫型):胃癌绝大部分为腺癌
印戒细胞癌
胃癌的9.9%,侵袭力强,病程进展快,恶性程度高
中青年女性
黏膜下层悄悄浸润
皮革胃,使胃变小,变硬,无法收缩
5年生存率为18.4%-44.1%
极端的肿瘤
对化疗不敏感
早期胃印戒细胞癌的预后
扩散和转移
直接浸润
直接侵犯周围脏器
沿淋巴网和组织间隙蔓延,向食道下端或十二指肠浸润
淋巴转移:最主要的转移方式
按淋巴引流方向转移
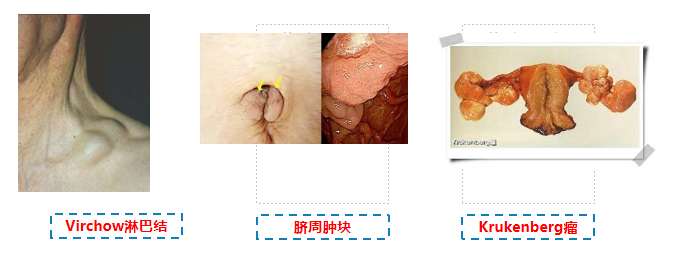
经胸导管转移到左锁骨上淋巴结(Virchow淋巴结)(这个淋巴结一定要记住,zpy说的);
经肝圆韧带转移到脐周
血行转移
肝、肺最多见,其次为胰、肾上腺、骨等
腹膜种植性转移
直肠指检触及肿块,Krukenberg瘤(卵巢转移)
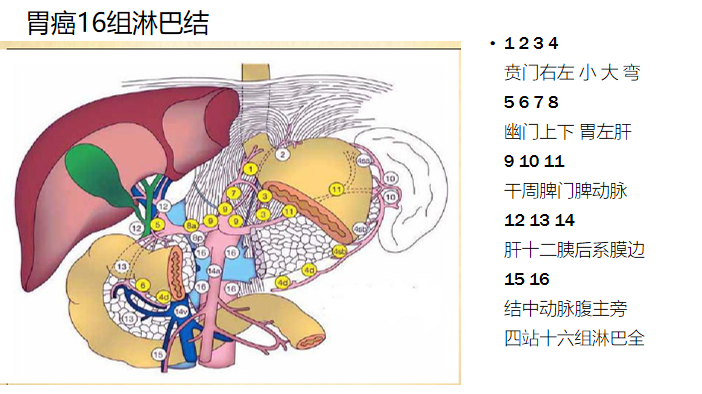
区域淋巴结分期变化
现规定的N只看淋巴结转移数目

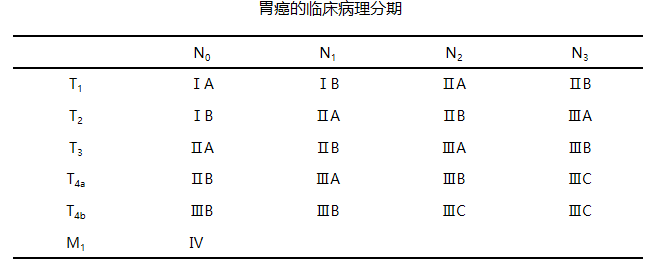
临床病理分期

临床表现
早期胃癌:多无症状,非特异性消化不良症状
进展期胃癌:上腹痛,伴纳差、腹胀、上腹部不适,体重下降
并发症或转移症状:咽下困难、幽门梗阻,上消化道出血,穿孔,转移受累器官症状(肝、肺)
体征:上腹部包块,上腹压痛,锁骨上淋巴结肿大,直肠前凹扪及肿块,腹水
诊断
早期诊断是关键
• 40岁以上,既往无胃病使而出现上述消化道症状者,或已有溃疡病史但症状和疼痛规律明显改变者
• 有胃癌家族病史者
• 有胃癌前期病变者,如萎缩性胃炎、胃溃疡、胃息肉、胃大部切除病史者
• 有原因不明的消化道慢性失血或短期内体重明显减轻者 :贫血!!!!!!!
X线钡餐检查
气钡双重造影 :龛影、充盈缺损、胃壁僵硬、黏膜紊乱等征象
纤维胃镜检查
直接观察胃黏膜
多点活检,病理学诊断
超声内镜
螺旋CT检查
可评价胃癌病变范围、局部淋巴结转移和远处转移
是判断胃癌术前临床分期(cStage)的首选方法
PET-CT
治疗
胃癌手术方式及其定义
早期胃癌
内镜下行胃黏膜切除术(EMR)和内镜下黏膜下剥离术 (ESD)
适应证:直径小于2cm的无溃疡表现的分化型黏膜内癌(T1a期)
手术治疗
根治性手术
• 标准胃切除术:以治愈为基本目的,包括至少2/3的胃切除并进行D2淋巴结清扫
• 非标准胃切除术
• 改良(缩小)手术:胃切除和/或淋巴结清扫范围有所缩小,不满足标准手术要求的手术术式,如 D1、D1+等
• 扩大手术:同时切除临近受累器官或淋巴结清扫范围超过D2
非根治性手术
姑息性手术:解除出血或梗阻,如姑息性胃切除术或胃空肠吻合术
减瘤手术:无证据表明延长生命或延迟症状的疗效,属临床试验性治疗
随机对照研究: REGATTA
胃切除范围
手术种类
➢ 全胃切除术(total gastrectomy,TG)含贲门(食管胃结合部)和幽门(幽门轮)的全胃切除
➢ 远端胃切除术(distal gastrectomy,DG)含幽门的胃切除术,保留贲门,标准手术为切除胃的2/3以上
➢ 保留幽门胃切除术(pylorus-preserving gastrectomy,PPG)保留胃上部1/3和幽门及部分的幽门前庭部的胃切除术
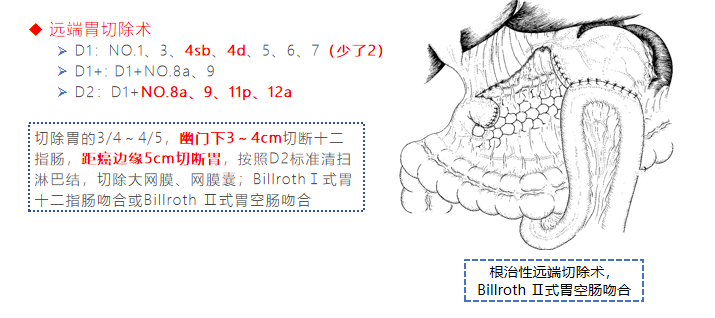
➢ 近端胃切除术(proximal gastrectomy,PG)含贲门(食管胃结合部)的胃切除术,保留幽门
➢ 胃分段切除术(segmental gastrectomy,SG)保留贲门、幽门的胃全周性切除,适合保留幽门胃切除术者除外
➢ 胃局部切除术(local resection,LR)胃的非全周性切除
非切除手术(吻合术、胃瘘及肠瘘造口术)
切缘
T2以上局限性的肿瘤需至少3cm,浸润型需5cm以上。如切缘距离低于以上要求,需对肿瘤近端切缘全层进行快速冰冻病理(IFS)检查以明确
胃切除术式的选择
标准术式:临床发现淋巴结转移cN(+)或T2~T4a期的肿瘤,依据以上切缘标准施行标准手术
全胃切除术
侵犯胰腺:全胃+胰腺+脾
位于胃大弯的肿瘤因4sb淋巴结转移可能:全胃+脾
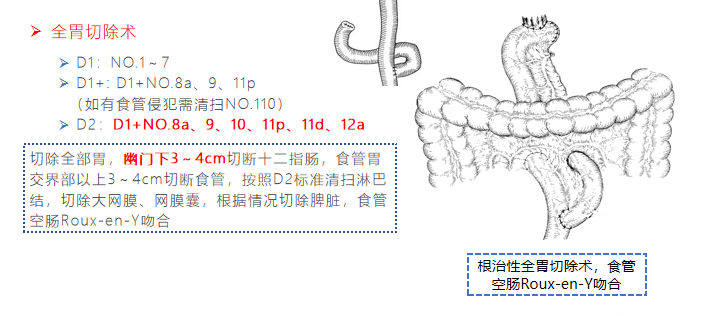
远端胃切除术
淋巴结清扫范围
区域淋巴结的定义
NO.1 ~ NO.12,NO.14v为区域淋巴结,转移至任何其它淋巴结归为M1
(还有哪些淋巴结呢)
淋巴结清扫数目
建议检查≥16个区域淋巴结确定N情况
清扫范围的确定
不再根据肿瘤的占居部位变更淋巴结清扫范围
依据不同的胃切除术式规定淋巴结清扫范围
全胃切除术
远端胃切除术
近端胃切除术
腹腔镜手术
腹腔镜下远端胃切除术
第一例LADG由日本医生于1991年完成
2009年的调查结果,近25%的胃癌根治术由腹腔镜手术完成
进展期胃癌微创手术的应用
目前仍有一定的争论,国外比较谨慎
缺乏符合循证医学要求的RCT研究,探索性开
(不用看)
胃癌的辅助治疗
新辅助治疗:缩小病灶,降低分期,体内药敏试验
前提是可行根治D2清除术的病例
强调术前分期(排除早期胃癌和不能切除者)
对术后复发或转移风险高的患者可获益
如肿瘤负荷过大:IIIB或IIIC,意义有限
术后化疗
——外科手术的基础上杀灭亚临床癌灶或脱落癌细胞,以达到临床治愈。
有淋巴结转移者或T3~T4者根治术后应作辅助化疗
T1~T2N0M0一般情况下不行术后辅助化疗
T2N0M0患者具有高危因素行术后辅助化疗:分化程度差;淋巴管,血管,神经受侵
考虑化疗时间是否以6个月比较合适,不要超过12个月。化疗时间长短缺乏进一步循证医学证据
传统方案:ECF等
新方案:FOLFOX/XELOX/5-FU/S-1/Cape等(氟尿嘧啶,铂类)
S-1成为胃癌辅助治疗的新标准
ACTS-GT方案(adjuvant chemotherapy trail of S-1 for gastric cancer):S-1单药
S-1+CDDP方案
分子靶向治疗的应用前景
已进入临床应用阶段
曲妥珠单抗(trastuzumab;herceptin): 人表皮生长因子-2(HER-2)表达阳性患者
贝伐珠单抗(bevacizumab)
西妥昔单抗 (Cetuximab)
胃癌的预后
与分期、部位(胃体)、组织类型、生物学特性及治疗措施有关
5年生存率
Ⅰ期:82%~95%
Ⅱ期:55%
Ⅲ期:15%~30%
Ⅳ期:2%
小结


三、胃肠道间质瘤(GIST)
掌握——胃肠间质瘤的临床表现和治疗原则
熟悉——胃肠间质瘤的病因和诊断方法
了解——胃肠间质瘤的靶向治疗
(一)概述
定义
是一组独立起源于胃肠道间质干细胞(Cajal细胞)的肿瘤,由未分化或多能的梭形或上皮样细胞组成,免疫组化通常过表达CD117(c-KIT基因编码KIT蛋白的抗原性抗体 )和DOG-1,属于消化道间叶性肿瘤
c-KIT是GIST的特征性标记物
➢ GIST起源于胃肠道的间质干细胞—Cajal细胞
➢ c-KIT(CD117)在GIST细胞中的阳性率达90%~95%,DOG-1阳性表达率98%,CD34阳性表达率70%~80%
➢ CD117、DOG-1及CD34联合检测,并联系病理形态学即可确诊GIST
流行病学特点
➢ GIST占消化道恶性肿瘤的1%~3%
➢ 每年发病率为(1~2)/10万
➢ 美国每年新发3000~6000例,平均5000例
➢ 从儿童至老年发病年龄范围广泛,无性别差异,75%发生在50岁以上人群
➢ 预计中国每年的发病人数在20 000~30 000例
分布
消化道任何部位均可发生,以胃和小肠最常见
胃——50%~60%
小肠——30%~35%
结直肠——5%~6%
肠系膜和网膜——4%~5%
(二)临床表现
症状
GIST的症状与肿瘤的部位、大小和生长方式有关
最常见的症状是腹部隐痛不适
部分病人腹部可触及包块
浸润到消化腔道内表现为溃疡或出血,大约1/3的病人可出现胃肠道出血
少见症状:食欲不振、体重下降、恶心、肠梗阻及阻塞性黄疸
(三)诊断
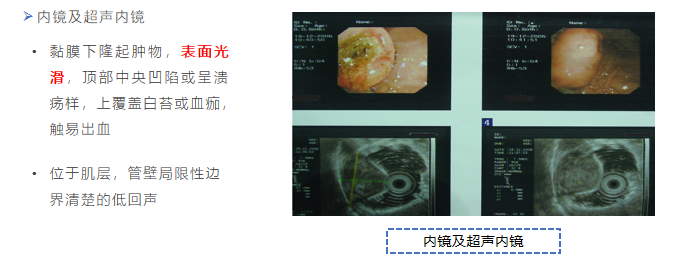
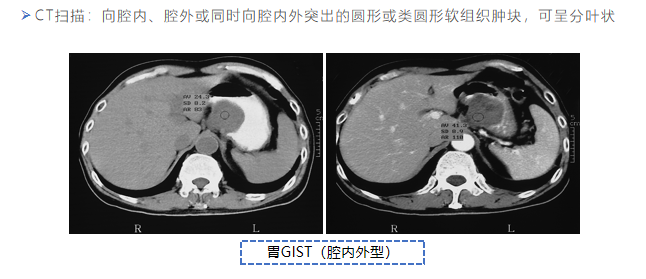
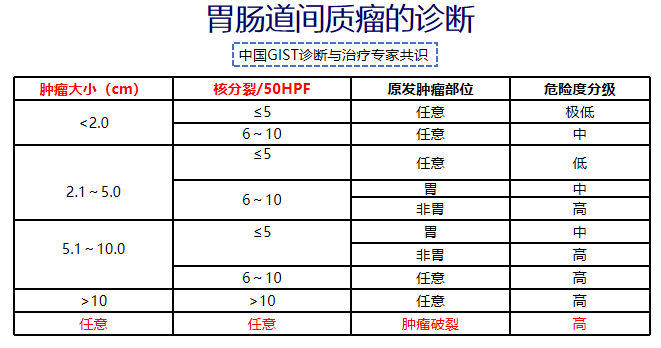
(四)治疗
1、外科治疗
➢ GIST的唯一根治手段,也是无转移病灶时的标准首选治疗。
➢ <2cm 小肠或直肠:手术治疗
胃部:超声内镜(不良因素:边缘不规则、溃疡、异质性、强回声),6~12个月复查
➢ 手术原则
要求完整切除(en bloc)、保证切缘阴性和避免肿瘤破裂溢出
肿瘤是否完全切除是独立的预后指标
血行转移为主,淋巴转移<5%,不需要常规进行淋巴清扫
2、分子靶向治疗
➢ c-kit原癌基因突变导致KIT酪氨酸激酶活化,是GIST形成的关键步骤。因此酪氨酸激酶抑制剂应该可以治疗GIST
➢ 甲磺酸伊马替尼(Imatinib,商品名格列卫,Gleevec)是最早用于治疗慢性粒细胞白血病的一种细胞信号传导抑制剂。2000年,Joensuu成功治疗转移性GIST一例。2002年,FDA通过
3、辅助治疗
➢ 术前新辅助:
(1)完整切除困难,难获阴性切缘
(2)可能需要联合脏器切除的GIST
(3)手术风险大、术后并发症发生率高的GIST
(4)GIST 切除同时牺牲脏器功能(比如Miles,无法保留肛门)
➢ 术后辅助治疗:
GIST 病人推荐继续使用格列卫预防复发, 但服药的时间没有完全定论。NCCN 推荐中高危组在完全手术切除后至少服用格列卫12个月。高危者可延长用药时间。
中危 胃GIST 1年; 中危,非胃GIST, 3年
高危 GIST 至少3年
➢ 转移复发性GIST
接受格列卫治疗后已有明显的肿瘤抑制作用的病人是否应该接受手术治疗?何时接受手术治疗?由医师根据具体情况确定
小结

四、胰腺肿瘤
掌握——胰腺假性囊肿的概念、诊断和治疗
熟悉——胰腺囊性疾病的分类
了解——胰腺囊性肿瘤、先天性真性囊肿和潴留性囊肿
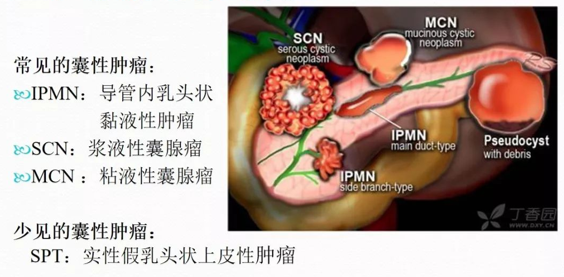
(一)胰腺囊性疾病
1、概述

2、胰腺假性囊肿
急慢性胰腺炎的并发症
胰液积聚在网膜囊内,刺激周围组织形成纤维包膜
多位于胰尾部
腹胀,可合并感染
手术指征:
1)持续腹痛,囊肿大于6cm
2)合并感染或者出血
内引流
外引流
胰体尾切除术或者胰十二指肠切除术
分型
1.坏死后Ⅰ型
继发于急性胰腺炎,囊壁成熟或不成熟,囊肿与胰管很少交通,ERCP显示胰管无异常。
2.坏死后Ⅱ型
见于慢性胰腺炎急性发作,囊壁成熟或不成熟,常与胰管相通,ERCP提示有慢性胰腺炎征象,但无胰管梗阻。
3.潴留性Ⅲ型
伴慢性胰腺炎,囊壁成熟与胰管交通,ERCP见胰管有明显的狭窄。这种分类有助于对治疗时机与方法的选择。
并发症
囊内出血
囊肿破裂
囊内感染
囊肿对周围的压迫
治疗方式
• 内科治疗 (抑酸,抑酶)
• 外科手术(大于6周)
• (胰体尾切除术或者胰十二直肠切除术)
• 内引流术
• 外引流术
小结
(二)胰腺癌和壶腹周围癌
掌握——胰腺癌和壶腹周围癌的临床表现和诊断方法
熟悉——胰腺癌和壶腹周围癌治疗原则
了解——胰腺癌和壶腹周围癌手术方式
胰腺癌特点
发病隐匿,进展迅速,预后极差,5年生存率小于8%
40岁以上好发,男性略多于女性
胰腺癌包括胰头癌(70%~80%)、胰体尾部癌,
90%的胰腺癌为导管腺癌
胰腺癌临床特点
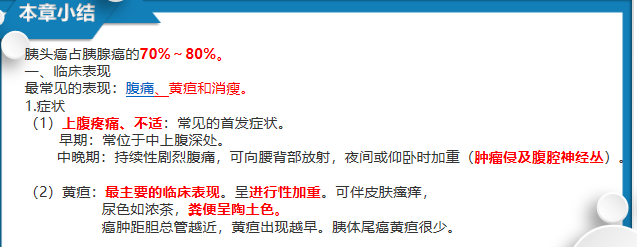
• 上腹疼痛、不适是常见的首发症状
• 无痛性黄疸是胰头癌最主要的临床表现,多数由胰头癌压迫或浸润胆总管所致,呈进行性加重
• 可伴消化道症状:如食欲不振、腹胀、消化不良、腹泻或便秘。
• 常伴消瘦、乏力、体重下降
• Courvoisier征(库瓦西埃)
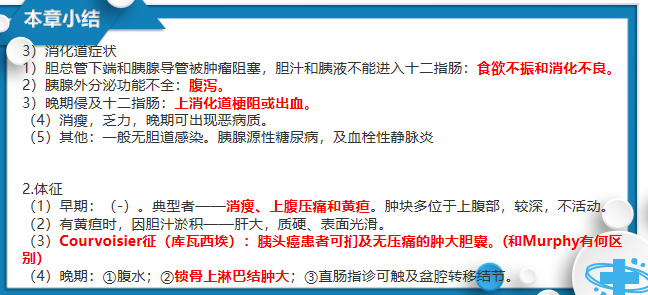
胰腺癌实验室检查
血清生化学检查
(1)早期可有血、尿淀粉酶的一过性升高
(2)胆道梗阻时,血清总胆红素和直接胆红素升高(直胆/总胆>50%)
免疫学检查
(1)包括CA19-9、CA24-2、CEA等
(2)CA19-9最常用于辅助诊断和术后随访
影像学检查
胰腺薄层扫描增强CT及三维重建:首选影像学检查手段
MRI或磁共振胆胰管造影(MRCP)
内镜超声(EUS)、ERCP
PET-CT
细针穿刺细胞学检查(FNA)
其他:腹部超声、经皮肝穿刺胆道造影(PTC)
胰腺癌可切除性评估
根据胰腺癌与周围血管及远处转移情况,分为:
可切除性胰腺癌、可能切除性胰腺癌及不可切除性胰腺癌
胰腺癌治疗原则
可切除性胰腺癌,手术切除是最有效的治疗方法,常用的手术方式包括胰头十二指肠切除术
可能切除性胰腺癌,建议先行新辅助治疗
不可切除性胰腺癌,可行姑息性手术治疗或辅助治疗
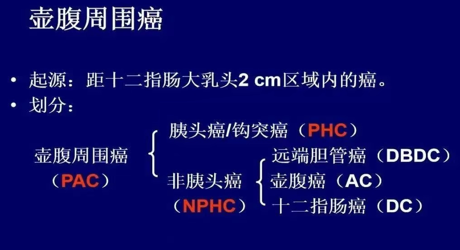
壶腹周围癌

小结
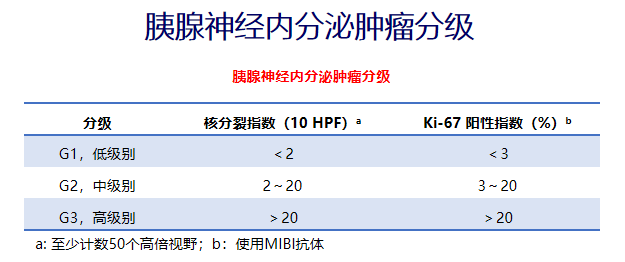
(三)胰腺神经内分泌肿瘤
概述
胰腺神经内分泌肿瘤(pNENs)约占原发性胰腺肿瘤的3%
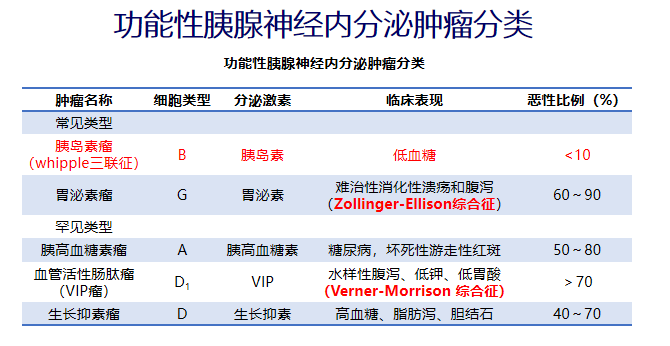
包括功能性和无功能性pNENs
常见的功能性pNENs包括胰岛素瘤和胃泌素瘤
胰岛素瘤
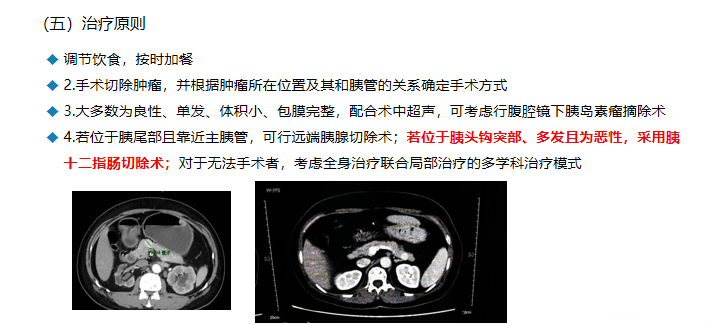
特点
最常见的功能性pNENs
女性略多于男性,高发年龄为40~50岁
大多为良性单发,体积小,直径一般为1~2cm
临床表现
首发症状为低血糖发作,容易误诊
经常发作低血糖,伴随头痛、视物模糊、思维不连贯、健忘、智商下降
长期定时加餐导致体重激增

胃泌素瘤
又称佐林格-埃利森综合征,发病率仅次于胰岛素瘤
包括散发性(SG)和多发性内分泌肿瘤I型(MEN-I)相关型两类(垂体,甲状旁腺以及胰腺内分泌)
60%以上的胃泌素瘤为恶性,常伴有淋巴结或肝转移
约90%位于胃泌素瘤三角
小结



五、肝肿瘤
掌握——原发性肝癌的诊断,鉴别诊断和治疗原则
熟悉——肝良性肿瘤和转移性肝肿瘤的治疗原则
了解——肝良性肿瘤和转移性肝肿瘤的分类
原发性肝恶性肿瘤
分类
1.肝细胞癌(简称肝癌,约占90%)
2.肝内胆管癌(约占10%)
3.肝肉瘤(罕见)
发病年龄多为40~50岁,男性多见
死亡率占肿瘤死亡率的第二位
病因
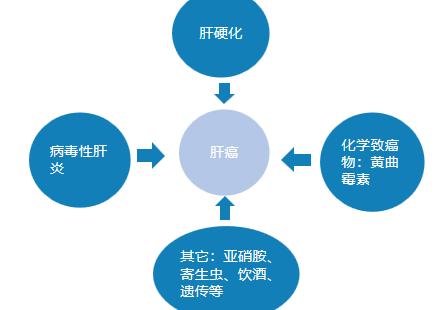
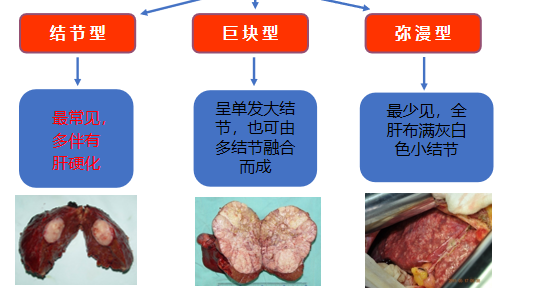
病理
肝癌转移途径
直接蔓延
淋巴管
门静脉
肝静脉
临床表现
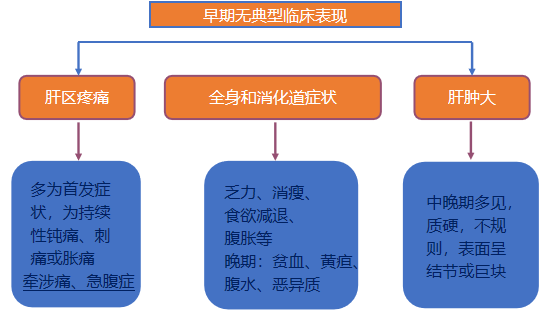
发热: 中、低度发热(抗生素无效)
特殊表现(癌旁表现):低血糖、红细胞增多症、高血钙、高胆固醇血症
其他:如发生肺转移可出现咳嗽,脑转移可出现头痛、头昏,骨转移出现病变处疼痛等
诊断
病史及临床表现
肝癌血清标志物
• 甲胎蛋白(AFP)
• AFP异质体 (L3, L3%>10%)
• 癌胚抗原(CEA)
• CA19-9
• PIVKA-II(维生素K缺乏或拮抗剂-II诱导的蛋白质, 大于300ug/L)
• AFU(α-岩藻糖苷酶)
• Ɣ-谷氨酰转肽酶同工酶II
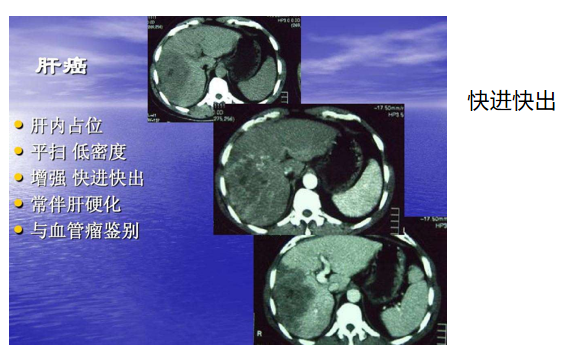
影像学检查
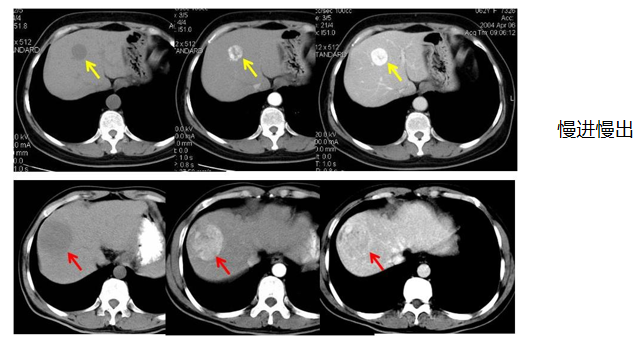
其他检查
肝穿刺活检
腹腔镜
鉴别诊断
继发性肝癌
肝硬化
良性肿瘤
邻近肝区肿瘤
肝脓肿
治疗

手术治疗
➢ 治疗肝癌的首选和最有效的方法
开腹/腹腔镜/机器人辅助下腹腔镜切除
术后5年生存率30%~50%
➢ 肿瘤数目/血管侵犯/AFP水平等因素影响手术治疗效果
肿瘤可切除性评估
没有肝外多处转移
单发微小肝癌或小肝癌
单发外生性生长的大肝癌或巨大肝癌,包膜完整,周围界限较清楚,受肿瘤破坏的肝组织少于30%
多个肿瘤,但少于3个,且局限于肝的一段或一叶内
符合下述条件者仅可作姑息性肝切除
3~5个肿瘤,局限于相邻2~3个肝段或半肝内,无瘤肝组织明显代偿性增大,达全肝组织的50%以上;如肿瘤分散,可分别作局限性切除
左半肝或右半肝的大肝癌或巨大肝癌,边界清楚,第一、二肝门未受侵犯,无瘤侧肝明显代偿性增大,达全肝组织的50%以上
位于肝1段或肝中央区(4、5、8段)大肝癌或巨大肝癌
肝门部有淋巴结转移者,如原发肝脏肿瘤可切除,可行肿瘤切除,同时进行肝门部淋巴结清扫
周围脏器(结肠、胃、膈肌或右肾上腺等)受侵犯,如原发肝脏肿瘤可切除,应连同受侵犯脏器一并切除
远处脏器单发转移性肿瘤(如单发肺转移),可同时切除原发癌和转移癌
肝移植——米兰标准
单个肿瘤直径不超过5cm
或肿瘤数目不超过3个,最大直径不超过3cm
不伴有血管及淋巴结的侵犯
消融治疗
• 借助医学影像技术的引导对肿瘤定位,局部采用物理或化学的方法直接杀灭肿瘤组织
• 包括射频消融(RFA)、微波消融(MWA)、冷冻治疗(Cryoablation)、无水酒精(PEI)注射等
• 特点:微创、安全、简便和易于多次施行
• 治疗途径:经皮、经腹腔镜手术和经开腹手术
• 适应证:不宜手术的原发肝细胞癌,或术后复发、转移性肝癌
其他治疗
• 肝动脉栓塞或化疗栓塞(TACE)
• 放射治疗:体内或体外放射
• 分子靶向治疗:索拉菲尼
• 全身化疗
• 中医药治疗
复发性肝癌的治疗
TACE
消融治疗
如一般情况良好,肝功能正常,病灶局限,也可再次手术切除
肝癌破裂出血的治疗
出血量不大,全身情况较好,可行TAE或TACE治疗
技术条件具备,也可行急诊肝切除术,根据术中情况,也可选择肝动脉结扎或纱布填塞止血等术式
肝内胆管癌
包括胆管细胞癌和胆管细胞与肝细胞混合型癌
ICC与HCV感染、HIV感染、肝硬化和糖尿病相关
AFP正常,CEA或CA19-9可升高
沿胆道浸润生长,确诊时可能已有肝内或淋巴结转移
首选手术切除,放疗和化疗的治疗效果有限
转移性肝肿瘤
又称继发性肝肿瘤,包括转移性肝癌和转移性肝肉瘤
原发肿瘤主要(57%)为结、直肠癌,胃癌,胰腺癌和胃、肠平滑肌肉瘤等。肺癌、乳腺癌、肾癌、宫颈癌、卵巢癌、前列腺癌和头颈部肿瘤等也可发生肝转移
分类
早发类,病人先有转移性肝肿瘤的临床表现,或转移性肝肿瘤先被发现,之后才找到原发肿瘤
同步类,同时发现原发肿瘤和转移性肝肿瘤
迟发类,发现原发肿瘤或原发肿瘤手术切除数月至数年后才发生肝转移
临床表现及诊断
➢ 肿瘤较小时,一般无症状,随着转移瘤增大,可出现上腹或肝区不适或隐痛;病情加重时,可出现乏力、发热、体重下降等;晚期病人可出现贫血、黄疸、腹水等
➢ 超声、CT、MRI和PET等影像学检查有重要诊断价值
➢ AFP升高者较少;CEA、CA19-9、CA125等对消化系统、肺、卵巢等器官癌肿的肝转移具有诊断价值
治疗
➢ 对于单发的转移性肝肿瘤,首选的、最有效的治疗方法是肝切除。
➢ 手术原则:完全切除肿瘤(切缘距肿瘤>1cm),最大限度保留健康肝组织
➢ 同步类,如原发癌和转移癌均可切除,可行同期手术切除
➢ 对不适应手术切除的肝转移癌或术中发现不能手术切除者,根据病人全身及原发肿瘤情况,选用区域灌注化疗、微波固化、射频消融、冷冻及放射等局部治疗
预后
➢ 病人预后与原发癌的性质、发生肝转移的时间、原发和转移癌发现时的严重程度,肿瘤对药物治疗的敏感度,以及个体因素等有关
➢ 总体上,转移性肝癌手术切除后5年生存率为25%~46%
肝良性肿瘤
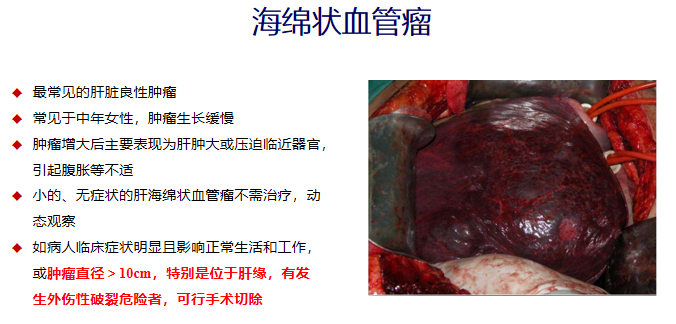
其他肝良性肿瘤
其他良性肿瘤,如肝腺瘤、血管内皮瘤、胆管囊腺瘤、脂肪瘤、神经纤维瘤等,均少见
有效的治疗方法是手术切除
小结


